Персоніфікований підхід у лікуванні синдрому подразненого кишечника: перспективи використання фармабіотиків
- ediensofficial
- 7 днів тому
- Читати 12 хв

Підписуйтесь на наші соціальні мережі, щоб стежити за останніми новинами тут 💜:
Сайт: www.ediens.me
LinkedIn: www.linkedin.com/ediens
Instagram: www.instagram.com/ediens_official
TikTok: www.tiktok.com/@ediens_official
УДК 616.34-008.6-021-085-027.552
Бурмей Світлана Андріївна,
аспірант, старший викладач кафедри медико-біологічних дисциплін
ДВНЗ «Ужгородський національний університет»
ORCID ID: 0000-0002-8157-4262
м. Ужгород, Україна
Бойко Надія Володимирівна,
доктор біологічних наук, професор,
завідувач кафедри медико-біологічних дисциплін
ДВНЗ «Ужгородський національний університет»
ORCID ID: 0000-0002-2467-7513
м. Ужгород, Україна
Персоніфікований підхід у лікуванні синдрому подразненого кишечника:
перспективи використання фармабіотиків
Вступ. Синдром подразненого кишечника (СПК) є поширеним гастроентерологічним розладом, що супроводжується хронічни-
ми функціональними порушеннями шлунково-кишкового тракту, зокрема болем у животі, здуттям, діареєю або закрепами. Тради-
ційні методи лікування, такі як дієта, регуляція моторики кишечника медикаментами чи застосування антидепресантів, не завжди
виявляються ефективними. У зв’язку з цим зростає інтерес до корекції симптомів СПК шляхом впливу на мікробіом кишечника за
допомогою пробіотиків – живих мікроорганізмів, що сприяють відновленню балансу кишкової мікробіоти.
Метою дослідження було визначити ефективність використання фармабіотиків для полегшення симптомів СПК та підвищення
якості життя пацієнтів шляхом відновлення балансу кишкової мікробіоти.
Матеріали та методи. Матеріалом для дослідження були випорожнення кишечнику від пацієнтів із синдромом подразненого
кишечнику. Мікробіологічне дослідження здійснювали шляхом кількісного посіву біоматеріалу на поживні середовища з подальшою
ідентифікацією виділених мікроорганізмів. Для підтвердження та уточнення результатів використовували метод мас-спектрометрії
MALDI-TOF. Персоніфікований підбір фармабіотиків базувався на основі визначення антагонізму між ізольованими із біоматеріалу
мікроорганізмами та фармабіотиками.
Результати та обговорення. У дослідженні виявлено, що найпоширенішим підтипом СПК є діарейний (СПК-Д), який діагнос-
тували у 61% пацієнтів. Хвороба частіше зустрічається у жінок, а середній вік пацієнтів варіює залежно від підтипу СПК, причому
для змішаного типу (СПК-Зм) характерна тенденція до старшого віку. Також встановлено суттєві відмінності у домінуванні мікро-
організмів у кишковій мікробіоті залежно від підтипу СПК.
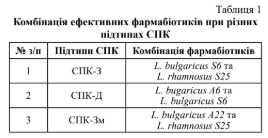
Висновки. Результати дослідження демонструють важливість індивідуального підходу до корекції кишкової мікробіоти.
При СПК-З ефективною є композиція фармабіотиків Lactobacillus bulgaricus S6 і L. rhamnosus S25, для СПК-Д – L. bulgaricus A6
і L. bulgaricus S6, а для СПК-Зм – L. bulgaricus A22 і L. rhamnosus S25. Застосування фармабіотиків може суттєво зменшити симпто-
ми СПК та покращити якість життя пацієнтів.
Ключові слова: діагностика, кишкова мікробіота, синдром подразненого кишечнику, фармабіотики, лактобактерії, персоніфіко-
ваний підхід.
Burmei Svitlana Andriivna, Postgraduate Student, Senior Lecturer at the Department of Medical and Biological Disciplines,
Uzhhorod National University, ORCID ID: 0000-0002-8157-4262, Uzhhorod, Ukraine
Boyko Nadiya Volodymyrivna, Doctor of Biological Sciences, Professor, Head of the Department of Medical and Biological
Disciplines, Uzhhorod National University, ORCID ID: 0000-0002-2467-7513, Uzhhorod, Ukraine
Personalized approach in the treatment of irritable bowel syndrome:
prospects for the use of pharmabiotics
Introduction. Irritable bowel syndrome (IBS) is a common gastroenterological disease characterized by chronic functional disorders
of the gastrointestinal tract, including abdominal pain, bloating, diarrhea, or constipation. Traditional treatment methods, such as dietary
modification, drug regulation of intestinal peristalsis, or antidepressants, are not always effective. Therefore, there is growing interest in
alleviating IBS symptoms by influencing the gut microbiome with probiotics – live microorganisms that help restore the balance of the gut
microbiota. This study aimed to determine the effectiveness of pharmabiotics in alleviating IBS symptoms and improving patients' quality of
life by restoring the balance of the gut microbiota.
Materials and methods. The study material was stool samples from patients with irritable bowel syndrome. Microbiological analysis
was performed using quantitative methods of culture on nutrient media, with the subsequent identification of isolated microorganisms. The
MALDI-TOF mass spectrometry method was used to confirm and clarify the results. Individual selection of pharmaceutical preparations was
based on the determination of antagonism between microorganisms isolated from the biomaterial and pharmabiotics.
Intermedical journal, випуск 1, 2025 р. 87
Results and discussion. The study showed that the most common subtype of IBS is the diarrhea-predominant type (IBS-D), diagnosed
in 61% of patients. The disease was more common in women, and the average age of patients varied depending on the subtype of IBS, with
a tendency towards an older age group in mixed-type IBS (IBS-M). Significant differences in the dominance of microorganisms in the gut
microbiota were also found depending on the subtype of IBS.
Conclusions. The results of the study emphasize the importance of an individual approach to the correction of the gut microbiota. For
IBS-C, an effective pharmabiotic composition Lactobacillus bulgaricus S6 and L. rhamnosus S25; for IBS-D – L. bulgaricus A6 and L.
bulgaricus S6; and for IBS-M – L. bulgaricus A22 and L. rhamnosus S25. The use of pharmabiotics can significantly reduce IBS symptoms
and improve patients' quality of life.
Key words: diagnostics, gut microbiota, irritable bowel syndrome, pharmabiotics, lactobacilli, personalized approach.
Вступ. Синдром подразненого кишечнику (СПК) є одним з найпоширеніших гастроентерологічних захворювань, яке характеризується хронічними пору- шеннями функцій шлунково-кишкового тракту (ШКТ), зокрема болем у животі, здуттям, діареєю чи закрепами [1, 2]. Попри його широку розповсюдженість та сут- тєвий вплив на якість життя пацієнтів, точні причини виникнення СПК досі залишаються предметом науко- вих дискусій. Сучасні дослідження в галузі мікробіоло- гії та медицини надають все більше доказів важливості кишкового мікробіому для здоров'я людини. Мікробі- ота кишечника є невід'ємною складовою метаболічних процесів: засвоєння поживних речовин, продукування енергії, а також різних обмінних процесів, таких як утворення вторинних жовчних кислот, перетворення холіну, забезпечення продукції вітамінів, жирних кис- лот і амінокислот, абсорбції важливих мікроелементів, бродіння та поглинання неперетравлених вуглеводів тощо [3, 4]. Розуміння взаємодії між мікроорганізмами кишечнику та їхнім впливом на імунну систему, обмін речовин та багато інших аспектів стає ключовим аспек- том для розробки нових стратегій лікування та профі- лактики різних захворювань, в тому числі і СПК. У здорових людей баланс між корисними та умовно-патогенними мікроорганізмами підтримується за допомогою природних механізмів організму [4, 5]. У пацієнтів із СПК, на відміну від здорових, спостері- гається дисбіоз – зміна складу та функцій мікробіому, що може призводити до порушення роботи кишечника. Встановлення взаємозв’язку між дисбіозом (дисбалан- сом мікробіому) та СПК відкрило нові можливості для терапії цього захворювання. Науковці [3] виявили, що у людей зі СПК зменшується кількість бактерій родів Lactobacillus та Bifidobacterium, які виконують захисну роль, а натомість збільшується кількість умовно-пато- генних мікроорганізмів, таких як Escherichia coli lac- та Clostridium. Дисбіоз може викликати запалення слизо- вої оболонки, підвищення чутливості нервових закін- чень у кишечнику, а також порушення роботи «барʼєра» між кишечником і кровоносною системою, що сприяє хронізації симптомів. Відповідно до діагностичних Римських критеріїв IV, СПК класифікується на чотири підтипи на основі переважної моделі випорожнень: СПК із закрепом (СПК-З), СПК із діареєю (СПК-Д), змішаний СПК із закрепами та діареєю (СПК-Зм) і некласифікований синдром подразненого кишечника [1, 2]. Традиційні підходи, такі як дієта, медикаменти для регуляції моторики кишечника чи антидепресанти, не завжди ефективні. Тому інтерес дослідників все час- тіше спрямовується на терапевтичну корекцію мікро- біому, зокрема за допомогою пробіотиків – живих мікроорганізмів, що здатні покращувати стан кишкової мікробіоти [7, 8]. Пробіотики мають унікальну власти- вість впливати на баланс мікробіоти кишечника через пригнічування росту умовно-патогенних мікроорганіз- мів, відновлюючи «здоровий» склад мікробіоти. Крім того, вони зміцнюють клітинні з’єднання епітелію, знижуючи проникність кишечника, знижують рівень прозапальних цитокінів, які викликають дискомфорт і біль, а також впливають на вісь "кишечник-мозок", знижуючи підвищену чутливість нервових закінчень, яка часто спостерігається при СПК [9]. Сучасні клінічні дослідження демонструють, що використання пробіотиків може зменшувати вира- женість симптомів СПК, таких як біль, здуття та порушення дефекації, а також сприяти покращенню якості життя пацієнтів [10]. Наприклад, пробіотики з Bifidobacterium infantis та Lactobacillus plantarum про- демонстрували ефективність у зменшенні запалення та нормалізації моторики кишечника [11]. Саме тому мікробіом розглядається не лише як важливий елемент патогенезу СПК, а й як перспективна мішень для тера- певтичного впливу [12]. Однак, вибір пробіотиків має бути індивідуаль- ним, адже їхній ефект залежить від конкретного штаму мікроорганізму, дози та тривалості прийому. Додатково варто враховувати особливості клінічного перебігу СПК у пацієнта. Все більше даних акцентують свою увагу саме на важливості персоніфікованого підхіду до лікування СПК [4-5, 13]. Дослідження можливості корекції синдрому подразненого кишечнику за допомогою фармабіоти- ків є актуальним через високу поширеність СПК, його значний вплив на якість життя пацієнтів та обмежену ефективність традиційних методів лікування. Викорис- тання фармабіотиків як інноваційного підходу, з ураху- ванням важливості персоніфікованої терапії, відкриває перспективи для більш точного та ефективного віднов- лення балансу кишкового мікробіому [14, 15]. Тому, метою наших досліджень було оцінити ефективність застосування фармабіотиків для корекції симптомів СПК та покращення якості життя пацієнтів через від- новлення балансу кишкової мікробіоти. Методологія та методи дослідження. Дослі- дження проведені із дотриманням основних положень GСP (1996) Конвенції Ради Європи про права людини та біомедицину (1997), Гельсінської декларації Всес- вітньої медичної асоціації про етичні принципи про- ведення наукових медичних досліджень за участю людини (1964–2008) і наказу МОЗ України No 960 від 23.09.2009 року. У дослідження були включені 100 пацієнтів з СПК в анамнезі, які звернулися до лабораторії «Едіенс» 88 Intermedical journal, випуск 1, 2025 р. з метою оцінки стану мікробіоти кишечника. Вік обсте- жених пацієнтів коливався від 18 до 82 років, і в серед- ньому становив 54,6±5,34 років. Мікробіологічні дослідження проводились на базі Науково-дослідницького та навчального Центру моле- кулярної мікробіології та імунології слизових оболонок ДВНЗ «УжНУ». Для виділення та ідентифікації мікро- організмів зразки випорожнення кишечнику, розведені у MRS бульйоні після серійних розведень (102 , 104 , 106 , 108 , 1010) висівали по 10 мкл кожного розведення на різні поживні середовища. В роботі були використані наступні селективні та хромогенні середовища: Mitis Salivarius Agar, Bile Esculin Agar, Mannitol Salt Agar, Endo Agar, Bismuth Sulphite Agar, HiCrome Clostridial Agar, Sabouraud Dextrose Agar, Lactobacillus MRS Agar, Bifidobacterium Agar, (виробник HiMedia Laboratories, Індія), ChromaticTM Detection (виробник Liofilchem, Італія). Чашки інкубували при при 37°C протягом 24–48 год та підраховували кількість колонієутворю- ючих одиниць (КУО) мікроорганізмів. Мікроскопію нативних мазків проводили з використанням методу Грама [16]. Ідентифікацію ізольованих мікроорганіз- мів здійснювали за допомогою біохімічних тест систем ANAERO-23, ENTERO-24, NEFERM-test, Candida-23, STAPHY-16, STREPTO test 24 (виробник LACHEMA, Брно, Чеська республіка). Для підтверджуючої (уточненої) ідентифікації використовували метод мас-спектрометрії MAЛДI (матрично-активована лазерна десорбція/іонізація). Метод полягає в дії імпульсів лазерного випромі- нювання на матрицю з аналізованим зразком [17]. Для ідентифікації мікроорганізмів використовували свіжі чисті культури (24–48 год інкубації). Для при- готування матричного розчину готували насичений розчин б-HCCA в 50% ацетонітрилі (AН), 2,5% три- флуоро-ацетній кислоті. Кристали б-HCCA поміщали в 200–500 мкл базового розчинника. Для повного розчи- нення суміш перемішували на вортексі декілька хвилин при кімнатній температурі. Приготований матричний розчин зберігали не більше одного тижня при темпера- турі 4 °С. Базовий розчинник складався з 50% ацетоні- трилу та 2,5% три-флуороацетної кислоти. Зчитування та аналіз зразків був повністю автоматизованим. Після завантаження металевої пластини з взірцями створю- вали вакуумні умови всередині камери затримуючи уві- мкнення аналізатора від 2 до 5 хв. Результати видава- лись в цифровому форматі. Для корекції мікробіоти при СПК застосовували персоніфікований підбір фармабіотиків із шести перспективних штамів лактобактерій: Lactobacillus bulgaricus S6, L. delbrueckii subsp. bulgaricus S19, L. rhamnosus S25, L. plantarum A, L. bulgaricus A6 та L. bulgaricus A 22 [18, 19]. Штами мікроорганізмів зна- ходяться в авторській колекції кафедри біотехнології Університету харчових технологій (University of Food Technology, Plovdiv) та люб’язно надані проф. Альбер- том Крастановим. Всі штами мають сертифікат відпо- відності Selur Pharma Ltd., Bulgaria. Дослідження про- водили in vitro. Композицію типових мікроорганізмів для СПК підбирали, враховуючи дані літератури та аналізуючи результати власних досліджень стану мікробіоти паці- єнтів з СПК [14, 20–21]. Персоналізований підбір фармабіотиків проводили шляхом спільного культивування мікроорганізмів, ізольованих з випорожнення кишечнику пацієнтів, та досліджуваних фармабіотиків [22]. Ефективними вважали ті, які проявляли антагоністичну дію по від- ношенню до етіологічно значимих умовно-патоген- них мікроорганізмів, концентрації, яких були за меж- ами норми, та не впливали на ріст представників коменсальної мікробіоти. Оцінка результатів дослі- дження, математичний аналіз та перевірка достовір- ності результатів здійснювалися на основі програм- ного забезпечення Statistica (STATISTICA) та Microsoft Office Excel 2019 (Microsoft Office). Виклад основного матеріалу дослідження з повним обґрунтуванням отриманих наукових результатів. Ідентифікацію ізольованих бактерій про- водили за допомогою напівавтоматичних біохімічних тест-систем PLIVA-Lachema (Чеська Республіка). Для підтвердження та уточнення результатів використо- вували метод мас-спектрометрії MALDI-TOF. Згідно анамнезу пацієнтів, які було надано ними особисто, відомо, що їх турбував рецидивний біль в животі щонайменше 1 день на тиждень протягом останніх 3 місяців, асоційований з двома і більше симптомами пов’язаними із дефекацією – зміна частоти та консис- тенції випорожнень. Усі пацієнти також скаржилися на порушення психоемоційного стану (тривожність, пору- шення сну, надмірна збудливість тощо). Згідно з діа- гностичними Римськими критеріями ІV пацієнтам був поставлений діагноз СПК та визначений його підтип (рис. 1). Як зазначено на діаграмі найбільш поширеним підтипом СПК є СПК-Д, який був представлений у 61% хворих. СПК-З та СПК-Зм поширені значно рідше – у 22% та 17% хворих, відповідно. Середній вік пацієнтів із СПК-З становив 52 роки, із СПК-Д – 48 років, а із СПК-Зм – 60 років (рис. 2). У всіх представлених підтипах СПК більшість пацієн- тів складали жінки. Слід відмітити, що із 22 пацієнтів з СПК-З 15 були жіночої статі, що становить 68%. При СПК-Д відсоток жінок із даним підтипом складав 72% (44 із 61), а при СПК-Зм даний відсоток становив 82% (14 із 17). Аналізуючи отримані дані, можна вважати, що дані підтипи СПК зустрічаються переважно жінок, а середній вік пацієнтів варіює залежно від підтипу, з тенденцією до збільшення віку у випадку СПК-Зм. Кишкова мікробіота при СПК-З представлена імуномодулюючими (Escherichia coli lac+ (100%)), лактатутворючими (Enterococcus faecalis (100%), Lactobacillus spp. (100%), зокрема L. brevis, L. plantarum та Bifidobacterium dentium (100%)) мікроорганізмами. Серед інших бактерій при СПК-З встановлено присут- ність умовно-патогенних Staphylococcus aureus – 50% та Actinomyces israelii – 25%. Частота виділення дріж- джеподібних Candida albicans становила 75% (рис. 3). Варто зазначити, що мікробіота кишечнику пацієн- тів із СПК-З характеризується переважанням грампо- зитивних мікроорганізмів різних форм, що продукують метаболіти, які впливають на скорочення гладких м'язів кишечника, посилюючи симптоми закрепів [23, 24].

Також виявлено підвищений рівень дріжджеподібних грибів та актиноміцетів. Нами встановлено, що мікробіота кишечнику при СПК-Д була представлена імуномодулюючими мікро- організмами (Escherichia coli lac+), лактатутворюю- чими (E. faecalis, Lactobacillus spp. (зокрема L. brevis, L. paracasei) частота виділення, яких становила 100%, Bifidobacterium spp. (частота виділення 85%)). У 65% випадків синдрому подразненого кишечника діарей- ного типу були виявлені облігатні анаероби Clostridium dificile. Необхідно відмітити 100% присутність LPS-бактерій, серед яких переважали Klebsiella oxytoca (75%), Citrobacter freundii (50%), Serratia marcescens (50%). (рис. 4). Мікробіота кишечнику у пацієнтів із СПК-Д харак- теризувалась домінуванням грамнегативних мікроор- ганізмів. Грамнегативні бактерії мають ліпополісаха- риди (ЛПС) у складі клітинної стінки, які є потужними ендотоксинами. K. oxytoca конкурує з коменсальними бактеріями кишкової мікробіоти, що порушує гомеос- таз і підсилює симптоми діареї. Крім того, підвищений рівень K. oxytoca посилює діарею через ушкодження слизової оболонки, внаслідок чого активується секре- ція хлоридів та натрію у просвіт кишечника, що сприяє накопиченню рідини [25]. Водночас їх метаболіти, зокрема аміни, можуть подразнювати нервові закін- чення, викликаючи спазми. Склад мікробіоти кишечника при змішаному СПК був представлений імуномодулюючими мікроорганіз- мами (E. coli lac+ (ч.в. 100%)), лактатпродукуючими (як E. faecalis (частота виділення становила 100%), Lactobacillus spp. (L. casei, L. plantarum) (ч.в. 100%), Bifidobacterium spp. (B. bifidum, B. dentium) (ч.в. 85%)), LPS-бактеріями(ч.в. 100%)

33%), Enterobacter cloacae (ч.в. 33%), Proteus vulgaris
(ч.в. 33%)). Слід також відмітити ріст мікроскопічних
грибів C. albicans (ч.в. 35%) (рис. 5).
Мікробіота кишечнику пацієнтів із змішаним типом
синдрому подразненого кишечника (СПК-Зм) харак-
теризується гетерогенністю, поєднуючи ознаки як діа-
рейної, так і форми із закрепом захворювання. Окрім
домінування імуномодулюючих та лактоутворюю-
чих бактерій, характерних для здорової мікробіоти,


REFERENCES
1. Kamiya T, Shikano M. Definition of Irritable Bowel Syndrome. Irritable Bowel Syndrome [Internet]. 2024;3–11. Available from: http://dx.doi.org/10.1007/978-981-97-8410-3_1 2. Waluga M. Biomarkers of irritable bowel syndrome. A Comprehensive Overview of Irritable Bowel Syndrome [Internet]. 2020;107–27. Available from: Available from: http://dx.doi.org/10.1016/b978-0-12-821324-7.00009-5 3. Zhao, Y., Zhu, S., Dong, Y., Xie, T., Chai, Z., Gao, X., Dai, Y., & Wang, X. The Role of Gut Microbiome in Irritable Bowel Syndrome: Implications for Clinical Therapeutics. Biomolecules, 2024;14(12):1643. Available from: https://doi.org/10.3390/ biom14121643 4. Understanding the Gut Microbiome: Implications for Health and Disease. JMHSR [Internet]. 2023 Jun. 30 [cited 2024 Dec. 23];1(1):20-33. Available from: https://jmhsr.com/index.php/jmhsr/article/view/27 5. The Microbiome and Its Role in Human Health: Exploring the Complex Interactions Between Gut Bacteria and Various Diseases. (2023). Journal of Medical & Health Sciences Review, 1(1):1-10. Available from: https://jmhsr.com/index.php/jmhsr/ article/view/25 6. Sienkiewicz M. Diet in irritable bowel syndrome. A Comprehensive Overview of Irritable Bowel Syndrome [Internet]. 2020;183–204. Available from: http://dx.doi.org/10.1016/b978-0-12-821324-7.00013-7 7. Burmei SA, Boyko NV. Key aspects of the use of new generation probiotic strains in 3P medicine: challenges and prospects. Intermedical journal [Internet]. 2024 May 31;(1):28–36. Available from: http://dx.doi.org/10.32782/2786-7684/2024-1-5 8. Britton RA, Hoffmann DE, Khoruts A. Probiotics and the Microbiome–How Can We Help Patients Make Sense of Probiotics? Gastroenterology [Internet]. 2021 Jan;160(2):614–23. Available from: http://dx.doi.org/10.1053/j.gastro.2020.11.047 9. D’Mello C, Swain MG. The gut–liver–brain axis: dietary and therapeutic interventions. The Complex Interplay Between Gut-Brain, Gut-Liver, and Liver-Brain Axes [Internet]. 2021;205–36. Available from: http://dx.doi.org/10.1016/b978-0- 12-821927-0.00007-3 10. Matyash LA. Efficacy of the use of the synbiotic Maxibalance in the complex therapy of the small intestine bacterial overgrowth syndrome in patients with irritable bowel syndrome with diarrhea. Medicine of Ukraine [Internet]. 2023 Feb 13; (1(267)):19–24. Available from: http://dx.doi.org/10.37987/1997-9894.2023.1(267).281401 11. Sharma S, Kumar S, Sajjad S, Sharma S. Probiotics in Irritable Bowel Syndrome: A Review Article. Cureus [Internet]. 2023 Mar 23; Available from: http://dx.doi.org/10.7759/cureus.36565 12. Anwer R, AlQumaizi K, Halim A, Halim K, AlOsaimi S. Irritable bowel syndrome: The role of probiotics in the systematic and successful treatment of irritable bowel syndrome. Imam Journal of Applied Sciences [Internet]. 2017;2(1):8. Available from: http://dx.doi.org/10.4103/ijas.ijas_2_18 13. Boyko N, Costigliola V, Golubnitschaja O. Microbiome in the Framework of Predictive, Preventive and Personalised Medicine. Microbiome in 3P Medicine Strategies [Internet]. 2023;1–8. Available from: http://dx.doi.org/10.1007/978-3- 031-19564-8_1 14. GAOUAR SBS. The Gut Microbiome and Human Health: Insights from Recent Research. Genet. Biodiv. J [Internet]. 2025 Jan. 13 [cited 2025 Jan. 25];9(1). Available from: https://journals.univ-tlemcen.dz/GABJ/index.php/GABJ/article/view/431 15. Menees S, Chey W. The gut microbiome and irritable bowel syndrome. F1000Research [Internet]. 2018 Jul 9;7:1029. Available from: http://dx.doi.org/10.12688/f1000research.14592.1 16. Ivashko M, Burmei S, Yusko L, Chaikovska T, Boyko N. Microbiological diagnostics: From traditional to molecular genetic methods: A literature review. Bulletin Of Medical And Biological Research [Internet]. 2023 Oct 16;5(4):34–41. Available from: http://dx.doi.org/10.61751/bmbr/4.2023.34 17. Shah HN, Gharbia SE, editors. MALDI‐TOF and Tandem MS for Clinical Microbiology. 2017 Apr 7; Available from: http://dx.doi.org/10.1002/9781118960226 18. Denkova R, Ilieva S, Denkova Z, Georgieva L, Krastanov A. Examination of the technological properties of newly isolated strains of the genus Lactobacillusand possibilities for their application in the composition of starters. Biotechnology & Biotechnological Equipment [Internet]. 2014 May 4;28(3):487–94. Available from: http://dx.doi.org/10.1080/1310281 8.2014.918701; 19. Denkova Z, Krastanov A. Development of New Products: Probiotics and Probiotic Foods. Probiotics [Internet]. 2012 Oct 3; Available from: http://dx.doi.org/10.5772/47827 20. Study of microbiome aberrations in patients with irritable bowel syndrome with diarrhea by next-generation sequencing. RESEARCH RESULTS IN BIOMEDICINE [Internet]. 2023 Dec 29;9(4). Available from: http://dx.doi.org/10.18413/2658-6 533-2023-9-4-0-2 21. The Microbiome and Irritable Bowel Syndrome: An Emerging Hope for Treatment. Gastroenterology Nursing [Internet]. 2024 May;47(3):E2–3. Available from: http://dx.doi.org/10.1097/sga.0000000000000825 22. Yusko LS, Burmei SA, Lemko IS, Krastanov AI, Boyko NV. The Use of Personalized Pharmabiotics as an Approach to the Rehabilitation of Post-COVID Patients. Mikrobiolohichnyi Zhurnal [Internet]. 2024 Sep 3;86(4):64–75. Available from: http://dx.doi.org/10.15407/microbiolj86.04.064 Intermedical journal, випуск 1, 2025 р. 93 23. Tian H, Chen Q, Yang B, Qin H, Li N. Analysis of Gut Microbiome and Metabolite Characteristics in Patients with Slow Transit Constipation. Digestive Diseases and Sciences [Internet]. 2020 Aug 7;66(9):3026–35. Available from: http://dx.doi.org/10.1007/s10620-020-06500-2 24. Chen Y, Wang Z, Chen X, Chao G, Zhang S. The role of gut microbiota and metabolites in regulating the immune response in drug-induced enteritis. Journal of Applied Microbiology [Internet]. 2023 Feb 20;134(3). Available from: http://dx.doi.org/10.1093/jambio/lxad032 25. Guţu N. Conditionally pathogenic agents of the family Enterobacteriaceae (Klebsiella and Enterobacter) causing acute diarrhea diseases. Bulletin of the Academy of Sciences of Moldova Life Sciences [Internet]. 2023 Mar;(3(347)):94–100. Available from: http://dx.doi.org/10.52388/1857-064x.2022.3.11



Коментарі